Человеческий протоонкоген c-HER-2/neu принадлежит к семейству тирозин-киназных рецепторов эпидермального фактора роста (EGFR) (Andrechek et al., 2000). Трансгенные мыши, несущие ген HER-2/neu, отличаются высокой частотой развития аденокарцином молочной железы и короткой продолжительностью жизни (Stocklin et al., 1993). В нашей лаборатории были изучены особенности старения трансгенных мышей HER-2/neu. Для сравнения была изучена низкораковая линия мышей SHR Проведенные исследования показали, что у трансгенных мышей опухоли молочной железы возникают в более раннем возрасте, и их число нарастает гораздо быстрее, чем у мышей SHR. Так, первые опухоли у трансгенных и низкораковых мышей обнаружены соответственно в возрасте 135 и 390 дней; средний латентный период их выявления составил 236 ±5.9 и 484 ± 14.9 (р < 0.001) (табл. 44, рис. 19) (Anisimov et al., 2003, 2003а).

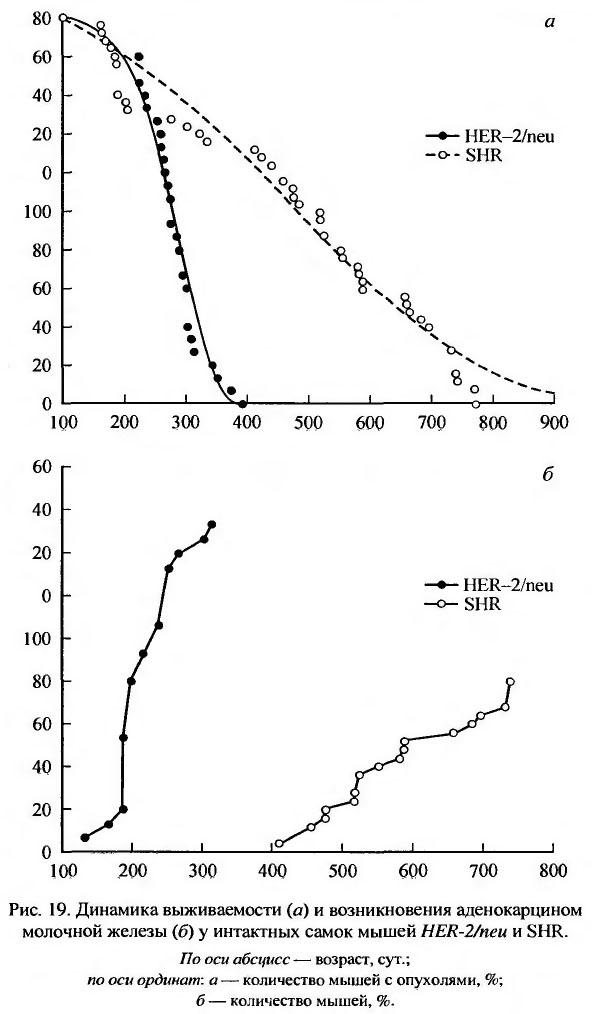
У трансгенных мышей-самок опухоли других локализаций обнаружить не удалось, тогда как у низкораковых мышей SHR отмечалось развитие лейкозов, опухолей легких и яичников. Возможно, это связано с тем, что из-за развития опухолей молочной железы трансгенные мыши погибали рано и не доживали до обнаружения опухолей других локализаций, которые у мышей SHR отмечали в возрасте 518-697 дней. Однако у трансгенных мышей часто отмечали неопухолевую патологию: поражение почек с кистозными изменениями канальцев, сморщиванием клубочков и интерстициальной мелкоклеточной инфильтрацией, а также атрофию фолликулов селезенки и атрофию печеночных балок. При этом в печени и селезенке отмечали скопление мелкозернистого содержимого. Отмеченные изменения напоминали нарушения обмена веществ, наблюдаемые при амилоидозе. Поскольку скопления амилоида характерны для стареющих животных, а также отмечаются при процессах старения у человека, можно предположить, что инкорпорация онкогенов может ускорять старение. У исходной линии мышей FVB/N, на основе которой была получена использованная нами линия HER-2/neu, патология почек не описана (Mahler et al,, 1996).
При оценке экспрессии онкогена HER-2/neu в опухолях молочной железы иммуногистохимическим методом высокое содержание онкобслка HER-2/neu выявлено во всех исследованных опухолевых тканях, а также в предопухолевых очаговых пролифератах молочных желез. Высокий уровень экспрессии онкогенов в опухолях молочной железы был выявлен также с помощью цепной реакции полимеризации (Anisimov et al., 2003a). Наши данные согласуются с работами других авторов, которые выявили амплификацию и повышенную экспрессию онкогенов у мышей с высокой частотой опухолей молочной железы (Andrechek et al., 2000).
При изучении показателей гомеостаза и биологического возраста у трансгенных мышей по сравнению с мышами SHR отмечено следующее; более низкая температура тела, несмотря на большее потребление корма, что, по-видимому, связано с особенностями обменных процессов у трансгенных животных; нарушение эндокринного баланса, что отразилось в увеличении числа иррегулярных циклов (в 2.5 раза). Подобное нарушение характерно для раннего старения. Изучение содержания рецепторов эстрогенов показало наличие рецепторов эстрадиола-17 во всех исследованных образцах тканей опухолей у трансгенных мышей (2-9 Фмоль/мг белка), в то время как рецепторы прогестерона не были обнаружены (Anisimov et al., 2003, 2003а; Берштейн и др., 2003). Сопоставление наших данных с литературными свидетельствует о том, что содержание стероидных рецепторов в опухолях молочной железы у мышей HER-2/neu является сравнительно невысоким и близко к уровню, отмеченному в спонтанных опухолях молочной железы мышей BALB/c (Lanari et al., 2001).
Поскольку известно, что интенсивность старения и канцерогенеза зависит от уровня свободнорадикальных процессов, изучались различные параметры генерации свободных радикалов и состояния антиоксидантной системы защиты у трансгенных мышей в сопоставлении с мышами низкораковой линии СВА Было установлено, что содержание некоторых продуктов перекисного окисления (диеновых конъюгатов) у трансгенных мышей было значительно больше, чем у низкораковых мышей (табл. 45).
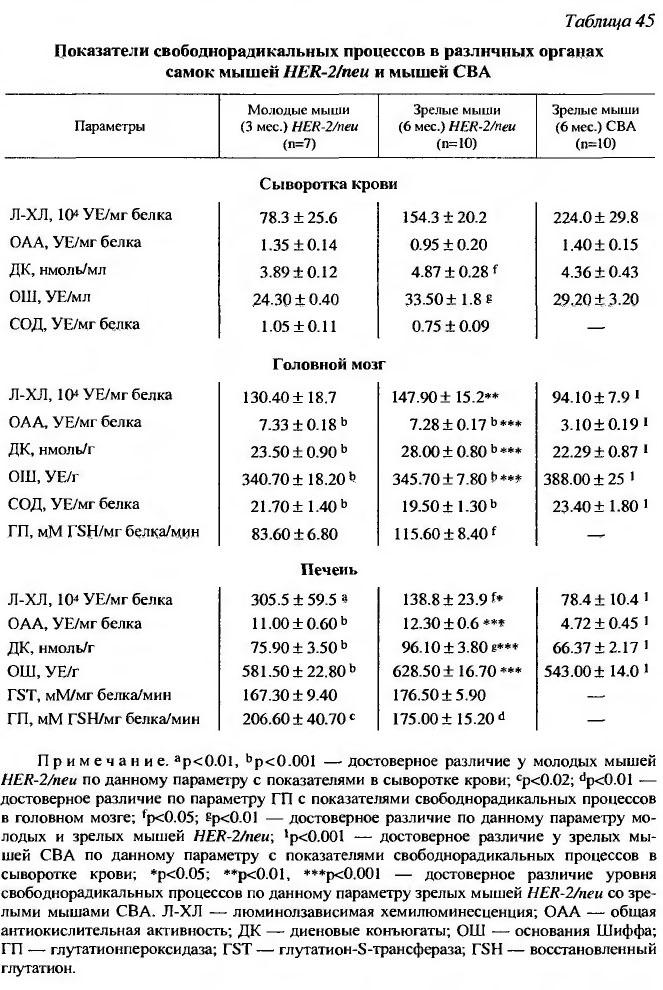
Это может свидетельствовать о более высоком уровне генерации свободных радикалов у трансгенных животных, способствующих раннему старению и развитию рака.
Одной из причин ранней гибели трансгенных мышей было развитие опухолей молочных желез. Другой причиной явились нарушения обмена веществ, связанные с поражением почек и других органов. Их частота была сравнима с частотой РМЖ, соответственно 63 и 77 %. Сравнимы были и средние сроки их обнаружения - 236 и 282 сут. В то же время у низкораковых мышей SHR частота поражения почек составила 2% (р<0.001), а частота опухолей - 48.7% (18/39). Средняя продолжительность жизни низкораковых мышей была в 1.7 раза больше, чем у трансгенных животных (р<0.001) (табл.44). В литературе также отмечена короткая продолжительность жизни трансгенных животных с инкорпорированными онкогенами рака молочной железы (РМЖ) и частое поражение почек (Ward et al., 2000).
В целом проведенный анализ показал, что мыши FVB/N с инкорпорированным геном HER-2 представляют собой удобную модель для изучения механизмов РМЖ и его связи со старением. Наши эксперименты показали роль онкогена HER-2/neu в развитии рака молочной железы, выявили особенности динамики появления опухолей, их морфологии, метастазирования, а также неопухолевой патологии, связанной с инкорпорированным онкогеном. Отмечены изменения некоторых показателей гомеостаза и биологического возраста, свидетельствующие об ускорении процессов старения в организме трансгенных мышей. Выживаемость мышей FVB/N дикого типа в возрасте 24 месяцев достигает 62%, а частота спонтанных опухолей составляет 66% (Mahler et al., 1996). У этих мышей спонтанно развиваются аденомы гипофиза, аденомы легких, опухоли яичников, аденомы гарднеропой железы, лимфомы, гистиоцитарные саркомы и феохромоцитомы, но не было выявлено случаев возникновения аденокарцином молочной железы. Важно отметить, что снижение экспрессии рббsch может быть существенно для развития рака молочной железы, экспрессирующей HER-2/neu (Stevenson, Frackelton, 1998).
См. также:
 6.4.4. Мыши с мутацией гена klotho
6.4.4. Мыши с мутацией гена klotho
 6.4.5. Трансгенные модели для изучения функции генов репарации ДНК
6.4.5. Трансгенные модели для изучения функции генов репарации ДНК
 6.4.6. Трансгенные мыши с суперэкспрессией гена Си, Zn-супероксид дисмутазы
6.4.6. Трансгенные мыши с суперэкспрессией гена Си, Zn-супероксид дисмутазы
 6.4.7. Мутационные и трансгенные модели иммуностарения
6.4.7. Мутационные и трансгенные модели иммуностарения
 6.4.8. Трансгенные модели возрастных нейродегенеративных заболеваний
6.4.8. Трансгенные модели возрастных нейродегенеративных заболеваний
 6.4.9. Мыши с нокаутным геном белка р53
6.4.9. Мыши с нокаутным геном белка р53
 6.4.10. Регуляция межклеточного взаимодействия и трансгенные модели
6.4.10. Регуляция межклеточного взаимодействия и трансгенные модели
 6.4.11. Теломераза: трансгенные и нокаутные мыши
6.4.11. Теломераза: трансгенные и нокаутные мыши
 6.4.13. Мутантные мыши с дефицитом зародышевых клеток
6.4.13. Мутантные мыши с дефицитом зародышевых клеток
 6.4.14. Мутации генов циркадных ритмов
6.4.14. Мутации генов циркадных ритмов
...
 Обсудить на форуме
Обсудить на форуме




