Процесс канцерогенеза, так же как процесс старения, сопровождается повреждениями генома, которые могут действовать синергично, способствуя развитию рака (Hanahan, Weinberg, 2000; Vijg, 2000; Luzatto, 2001; Balmain et al., 2003). Среди этих нарушений ключевую роль играют три развивающихся с возрастом изменения в ДНК: нестабильность генома, гипометилирование ДНК и образование аддуктов ДНК.
Нестабильность генома возникает при активации генов, таких как клеточные протоонкогены, которые в норме супрессированы, и/или инактивация опухолевых супрессорных генов (р53, Rb и некоторых других) (Kinzler, Vogelstein, 1997; Имянитов, 1999; Hanahan, Weinberg, 2000). Гипометилирование ДНК - такая же характерная черта трансформированных клеток, как и старения. Являясь одним из потенциальных механизмов активации онкогенов, гипометилирование может приводить к спонтанному деаминированию цитозина и последующей транзиции пар оснований, то есть замене пары тимин-аденин. Накопление несоответствующих пар оснований, приводя к активации клеточных протоонкогенов, может быть причиной опухолевой трансформации (Hanahan, Weinberg, 2000). Возрастные нарушения обмена ДНК могут быть ткане- и геноспецифичными. Так, гипометилирование протоонкогена с-mус было обнаружено в гепатоцитах, но отсутствовало в нейронах старых мышей (Matoha et al., 1987; Ono et al., 1993). Даже в пределах одной клетки различные сегменты ДНК могут в разной степени подвергаться гипометилированию при старении. Неравномерное распределение гипометилиррвания может приводить к избирательной избыточной экспрессии протоонкогенов старой клеткой. Например, транскрипция с-mус прогрессивно увеличивалась с возрастом в печени, но не в мозге крыс, между 4-м и 22-м месяцами жизни, тогда как транскрипция c-sis и c-src не изменялась с возрастом ни в одной из изученных тканей (Matoha et al., 1987; Ono et al., 1993). Различная степень повреждения ДНК в разных тканях при старении может определять, по крайней мере частично, различия в чувствительности этих тканей к канцерогенам (Catania, Fairweather, 1991).
Считается, что повреждения ДНК, вызываемые эндогенными активными формами кислорода (АФК), вносят основной вклад в развитие процессов старения и канцерогенеза (Yu, 1993; Shigenaga et al., 1994). Установлено, что степень эндогенного окислительного повреждения липидов и белков увеличивается с возрастом (Ames et al., 1993). АФК вызывают мутации, активирующие протоонкоген c-Ha-ras человека (Du et al., 1994). Концентрация окисленного нуклеозида 8-гидрокси-2'-дезоксигуанозина в ДНК увеличивается с возрастом в печени, почках и кишке, но остается неизменной в мозге и яичках крыс, при этом экскреция его с мочой с возрастом уменьшается (Fraga et al., 1990).
Имеются многочисленные доказательства накопления с возрастом спонтанных мутаций в соматических и половых клетках (Vijg, 2000; Розенфельд, 2001). Этот процесс может приводить к нестабильности генома и, следовательно, увеличивать чувствительность к действию канцерогенов и опухолевых промоторов. Клонально распространяющиеся мутации митохондриальной ДНК (мтДНК) накапливаются с возрастом как в нормальных тканях, так и в опухолях человека (Nekhaeva et al., 2002). Наблюдения, что в мышечной ткани человека с возрастом накапливаются делеции мтДНК и происходит ее частичное удвоение (Bodyak et al., 2001), позволяют предполагать важную роль клональной экспансии мутантной мтДНК в развитии при старении системного окислительного стресса в организме в целом (de Grey, 2000). Была обнаружена существенная тенденция к увеличению с возрастом частоты мутаций в онкогене р53 в различных тканях и опухолях (Ouhtit et aL, 1997; Liang ct al., 1999). Simpson (1997) полагает, что в теле пожилых людей происходит отбор предсушествующих мутаций, что способствует накоплению достаточного количества мутаций для запуска многостадийного процесса канцерогенеза. Указывают, что в развитие опухоли вносят свой вклад как генетические особенности отобранных клеточных клонов, так и эпигенетические особенности окружающей среды (Chow, Rubin, 2000).
Потомки 25-месячных самцов крыс, спаренных с 3-месячными самками, имели большую чувствительность к канцерогенному действию НММ по сравнению с потомством молодых самцов и самок (Anisimov, Gvardina,1995). Использовав материалы базы данных Шведского ракового регистра для анализа влияния возраста отца на частоту рака у потомства в возрасте 15-53 лет, К. Hemminki и P. Kyyronen (1999) установили, что больший возраст отца увеличивает риск развития спорадических опухолей нервной системы на 15 %, тогда как возраст матери имеет значение в развитии меланомы и лейкозов, проявляясь 30 % увеличением их риска в случаях, когда матери были старше 40 лет, по сравнению с потомством матерей, которые были моложе 20 лет. Предполагается, что накопление хромосомных аберраций и мутаций в половых клетках ответственно за развитие опухолей у потомства (Hemminki, Kyyronen, 1999). Выявлено трехкратное превышение риска развития ретинобластомы у детей, отцам которых было 45 лет и более, по сравнению с потомством более молодых отцов (Dockerty et al., 2001). В этом же исследовании представлены данные, свидетельствующие о том, что риск острого лимфолейкоза существенно увеличен у детей, чьи родители были старше, и была выявлена отчетливая положительная тенденция к увеличению риска рака при увеличении возраста отца и матери. Следует отметить, что частота мутаций в сперматогенных клетках старых мышей существенно повышена по сравнению с таковой у молодых мышей или животных среднего возраста (Walter et al., 1998). Было обнаружено, что у людей частота новых доминантных мутаций увеличивается экспоненциально с увеличением возраста отца, но не матери (Risen et al., 1987).
Таким образом, имеющиеся данные свидетельствуют о том, что ряд возрастных изменении в структуре и функции ДНК вовлечен в процесс естественного старения. Характер этих изменений может различаться в разных тканях, что определяет неравномерность скорости их старения. Недавно DoIIe и соавт. (2002), использовав трансгенных мышей с встроенным шаттл-вектором lacZ, определили спектр спонтанных точечных мутаций в различных органах молодых и старых животных. В то время как спектр мутаций был одинаков в органах молодых мышей, он существенно различался у старых животных. Авторы подчеркивают, что сама по себе репликативная история тканей не является причиной органоспецифичных различий спектра мутаций в старческом возрасте. Скорее, различия в функции органов, связанные с их репликативной историей, могут приводить к расхождениям в спектре мутаций в процессе старения. Это в свою очередь может объяснить как возрастное увеличение частоты спонтанных опухолей, так и возрастные изменения в чувствительности разных органов к канцерогенным агентам.
Канцерогенез - многостадийный процесс, в течение которого нормальная стволовая клетка проходит последовательно несколько стадий, прежде чем станет полностью злокачественной (Напалков и др., 1987; Ponten, 2001; Reya et al., 2001; Schlessinger, Van Zam, 2001). Многостадийный канцерогенез сопровождается многообразными нарушениями тканевого гомеостаза и нарушениями в нервной, эндокринной и иммунной системах, которые угнетают противоопухолевую резистентность организма. Развитие этих нарушений зависит от чувствительности различных систем к действию канцерогенов и от дозы канцерогена. Изменения в микроокружении поврежденной клетки играют ключевую роль в канцерогенезе и определяют длительность каждой стадии канцерогенеза, и при некоторых условиях могут даже вызывать обратное развитие опухолевого процесса. В конечном счете изменения в микроокружении оказывают решающее влияние на скорость пролиферации трансформированных клеток, общую длительность канцерогенеза и соответственно латентный период развития опухоли (рис. 17).

Взаимодействие между мезенхимой и эпителием - ведущий фактор дифференцировки и развития (Liotta, Kohn, 2001). Установлено, что изменения в поведении стромы может оказывать промотирующее влияние на опухолевую трансформацию эпителиальных клеток канцерогенез (Krtolica et al., 2001). К специфическим медиаторам возрастных изменений во взаимоотношениях клеток стромы и эпителия относят интерлейкин-1, трансформирующий фактор роста , ростовые факторы кератиноцитов и гепатоцитов, фактор, происходящий из клона 1 пигментого эпителия на ранних стадиях удвоения (PEDF/EPC-1), принадлежащего к семейству ингибиторов сериновых протеаз (Rinehardt, Torti, 1997).
Есть основания полагать, что с возрастом в тканях организма происходит накопление клеток, которые находятся на поздних стадиях многостадийного процесса канцерогенеза. Об этом свидетельствуют результаты многих экспериментов. Так, при однократной аппликации на кожу 8- или 48-недельных мышей ДМБА в дозах от 10 до 300 мкг наблюдали увеличение частоты развития папиллом у более старых животных (табл. 30) (Stenback et al., 1981). У них опухоли достигали больших размеров.

Частота развития папиллом кожи после смазывания ее 12-О-тетрадеканоилфорбол-13-ацетатом (ТФА) была в 6 раз выше у 14-месячных мышей по сравнению с 4-месячными (Stenback et al., 1981). Большой интерес представляют результаты опытов с реципрокной пересадкой кожных лоскутов. Нанесение ТФА на трансплантат кожи от 2-месячных доноров реципиентам разного возраста не вызывало у них развития опухолей. Однако опухоли кожи возникали с одинаковой частотой, когда ТФА наносился на лоскуты годовалых доноров вне зависимости от возраста реципиентов (Ebbesen, 1985). Эти наблюдения убедительно свидетельствуют о том, что только возраст ткани-мишени определяет ее чувствительность к воздействию опухолевых промоторов.
Нанесение кожных ран через 16 недель после аппликации инициирующей дозы канцерогена приводило к более интенсивному развитию опухолей по сравнению с таким же ранением, но произведенным лишь спустя 6 недель после нанесения канцерогена у молодых мышей (Hennings, Boutwell, 1970). Отложенная промоция также была эффективней при использовании в качестве промотора хризаробина или мезереина (Kruszewski et al., 1987). Эти наблюдения согласуются с данными о возрастном снижении эффективности репарации ДНК в коже (Moriwaki et al., 1996; Wei, 1998) и увеличении частоты мутаций в антионкогене р53 по мере увеличения возраста в нормальной коже человека (Ouhtit et al., 1997) и в базальноклеточных карциномах кожи (D'Errico et al., 1997; Liang et al., 1999). Однако в некоторых исследованиях частота развития папиллом кожи не зависела от возраста, в котором воздействовали канцерогеном и промотором опухолевого роста, или даже снижалась (Roe et al., 1972; Van Duuren et al., 1975). Имеются данные о снижении репарации повреждений ДНК, индуцируемых ультрафиолетовым облучением (УФО) и последующим накоплением мутаций в первичных культурах фибробластов кожи от здоровых доноров в возрасте от О до 100 лет (Moriwaki et al., 1996). Предполагается, что с возрастом увеличивается количество экспрессирующих теломеразу базальных клеток в коже (Ueda, 2000).
У трансгенных мышей Tg.AC, трансфецированных онкогеном v-Ha-ras, частота возникновения папиллом кожи и их множественность была существенно большей при аппликации ТФА, нанесении кожной раны или воздействии УФ облучения в возрасте 32 недель по сравнению с такими же воздействиями в возрасте 10 недель (табл. 31) (Battalora et al., 2001).

Авторы полагают, что естественные процессы, происходящие в кератиноцитах при старении, кооперируются с молекулярными механизмами, вызывающими индукцию экспрессии трансгена, тем самым оказывая стимулирующее влияние на развитие опухолей кожи у старых мышей.
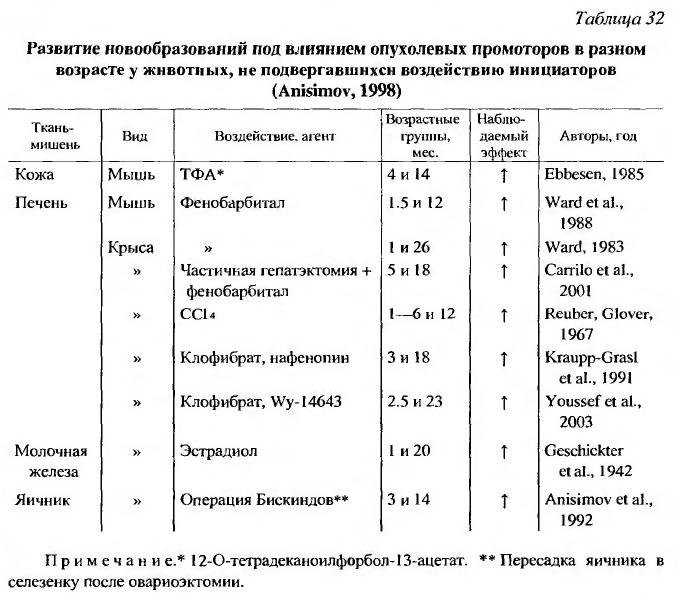
О возрастном накоплении в тканях клеток, которые находятся на поздних стадиях канцерогенеза, свидетельствуют результаты и других опытов. Модель гепатоканцерогенеза у мышей весьма удобна для изучения этого вопроса, поскольку имеется много линий мышей с различной чувствительностью к гепатоканцерогенезу. У мышей, высокочувствительных к гепатоканцерогенам линий, концентрация гепатоцитов, находящихся на последних стадиях канцерогенеза, быстро увеличивается с возрастом (Lee et al., 1989). В печени крыс линии F344 число спонтанных пролиферативных узелков прямо пропорционально возрасту животных (Ward et al., 1988; Kraupp-Grasl et ah, 1991). Частота пролиферативных узелков и гепатом, индуцируемых фенобарбиталом, четыреххлористым углеродом или веществами, вызывающими пролиферацию клеточных пероксисом (клофибрат, нафенопин), была существенно выше, если воздействие начинали у старых животных {Ward, 1983; Ward et al., 1988; Kraupp-Grasl et al., 1991; Youssef et al., 2003). Другая модель была использована для индукции лимфом у мышей, которым вводили взвесь клеток селезенки, тимуса и лимфоузлов от сингенных доноров разного возраста (Ebbesen, 1971). Частота развившихся ретикулосарком была пропорциональна возрасту донора, но не реципиента. S. F. Geschickter и соавт. (1942) наблюдал развитие опухолей молочной железы при введении эстрогенов, начатом в возрасте 1 или 20 месяцев, через 9.5 и 3 месяца соответственно (табл. 32).
НММ в дозах 10, 20 или 50 мг/кг вводили однократно в вену самкам мышей в возрасте 3 или 15 месяцев (Anisimov, 1993). Произведенные в соответствии с многостадийной моделью канцерогенеза расчеты показали, что число стадий, необходимых для развития злокачественных опухолей при введении канцерогена 15-месячным мышам было меньшим, чем при воздействии в возрасте 3 месяцев. В этом опыте, так же как и в ряде других, с введением НММ крысам и мышам опухоли развивались быстрее у старых животных, чем у молодых (Anisimov, 1993, 1995, 1998а). Частота развития атипической гиперплазии и аденокарцином эндометрия увеличивалась пропорционально интервалу между инициирующим введением мышам НММ и началом промотирующего воздействия эстрадиола (Takahashi et al. 2001). Разработка новой оптической системы, основанной на светоразделяющей спектроскопии, позволяющей выявлять предраковые процессы и преинвазивные карциномы в теле человека (Backman et al., 2000), может оказаться весьма перспективной для количественной характеристики их накопления с возрастом в различных тканях. В табл. 33 приведены данные об органах старых крыс, в которых были обнаружены очаги гиперплазии и пролиферации.

Некоторые эксперименты ш vitro подтверждают наблюдения, сделанные на животных. Так, воздействие ДМБА вызывало более быстрое появление фокусов трансформации в эпителии мочевого пузыря (на 40-60-й день) и с большей частотой (25%) в эксплантатах старых (28-30 мес.) мышей, по сравнению с эксплантатами молодых (5-7 мес.) животных, у которых очаги трансформации можно было обнаружить через 100 дней в 0,9% случаев. Случаи спонтанной трансформации эпителия мочевого пузыря наблюдались только в эксплантатах старых мышей {Summerhayes, Frank, 1979), Первичные культуры фибробластов от старых крыс были более чувствительны к трансформации, индуцируемой вирусом SV-40, чем от молодых (Kunisada et al., 1990). Однако Nettesheim и соавт. (1981) сообщили, что чувствительность эксплантатов эпителия трахеи старых животных к канцерогенам была меньшей, чем эксплантатов от молодых животных.
Следует подчеркнуть, что число событий (стадий), необходимых для полной трансформации нормальной стволовой клетки весьма вариабельно и зависит от скорости старения самой ткани-мишени и систем, ее регулирующих (рис. 18) (Anisimov, 1998).

Этой модели соответствуют данные о возрастном распределении частоты опухолей различных локализаций у человека и животных (Anisimov, 1987; Parkin et al., 2001). Старые животные могут быть вполне адекватной моделью для оценки канцерогенное™ агентов с предполагаемой невысокой канцерогенной активностью и опухолевых промоторов (Анисимов, 1989, 1997,2002; Anisimov, 1998a).
См. также:
 5.1. Введение. Гипотезы о взаимосвязи рака и старения
5.1. Введение. Гипотезы о взаимосвязи рака и старения
 5.2. Возрастное увеличение частоты спонтанных опухолей
5.2. Возрастное увеличение частоты спонтанных опухолей
 5.3. Чувствительность к канцерогенам в разном возрасте
5.3. Чувствительность к канцерогенам в разном возрасте
 5.5. Влияние старения на рост перевиваемых опухолей
5.5. Влияние старения на рост перевиваемых опухолей
 5.6. Клеточное старение и канцерогенез: роль теломер и теломеразы
5.6. Клеточное старение и канцерогенез: роль теломер и теломеразы
 5.7. Канцерогенное старение
5.7. Канцерогенное старение
 5.8. Ускоряет ли преждевременное старение развитие опухолей?
5.8. Ускоряет ли преждевременное старение развитие опухолей?
 5.9. Окислительный стресс, старение и канцерогенез
5.9. Окислительный стресс, старение и канцерогенез
 5.10. Увеличение продолжительности жизни и риск рака
5.10. Увеличение продолжительности жизни и риск рака
 5.11. Заключение
5.11. Заключение
 Обсудить на форуме
Обсудить на форуме







