Геном зиготы и Эск находится в так называемой "нулевой точке", откуда стартуют две главные программы эмбриогенеза:
1) гаструляция + органогенез
2) рестрикционное созревание дифференцированных клеточных линий.
Эти две программы задействуют примерно 5000 генов эмбриогенеза. Каким образом реализуется тотипотентность генома, т.е. способность выбирать одну из многих траекторий развития? Серийный анализ генной экспрессии (SAGE) в культуре Эстволовые клетки, мезенхимальной, нейрональной и гематогенной стволовой клетки выявил важнейшую закономерность (Kelli D.L., Rizzino A, 2000; Xiong J.W., Battaglino R., Leahy A. et al.,1998). Во всех перечисленных стволовых клетках присутствовали сходные наборы предсинтезированных мРНК следующих классов генов (Рис 1-8).
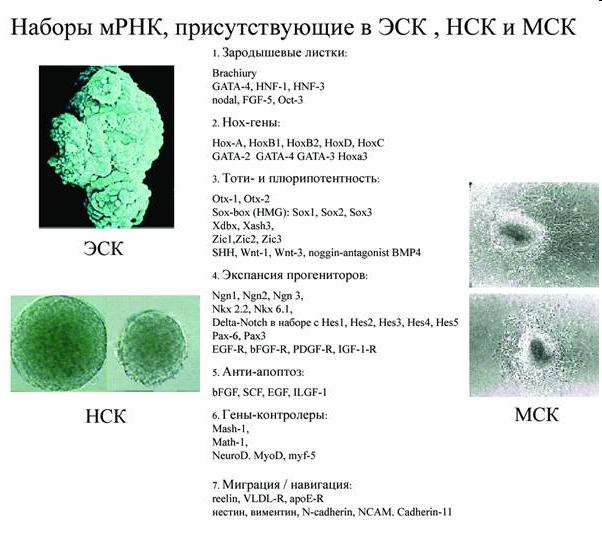
Рис 1-8 Молекулярные основы тотипотентности стволовых клеток
1) ранних генов экто-, мезо- и эндодермы
2) набор мРНК гомеотических (Нох) генов, контролирующих сегментацию и трехмерную карту зародыша
3) пять наборов мРНК генов тотипотентности. Каждый набор факторов тотипотентности увязан с комплементарным набором факторов и рецепторов пролиферации на прогениторных клетках в клоне. Особенно существенны спаренные блоки генов, контролирующие пролиферацию соседних слоев прогениторных клеток в клоне (типа Delta/Notch)
4) мРНК генов апоптоза, контролирующие численность прогениторных клеток в клоне. Баланс клеток достигается за счет миграции и частичной гибели клеток в клоне. Пролиферация постоянно уравновешивается миграцией и апоптозом клеток.
5) набор мРНК контрольных генов (master genes) рестрикционного созревания специализированных клеточных линий (Terskykh A.,Easterday M., Linheng L. et al., 2001)
6) наборы мРНК генов миграции и навигации миграторных клеток
Таким образом, в основе тотипотентности Эстволовые клетки, Мск и других стволовых клеток выявлен универсальный механизм: направленная активация и последующий импорт мРНК в ядро. Детали импорта/экспорта информации между ядром и цитоплазмой в Эск плохо изучены. Эта концепция тотипотентности подтверждется новыми наблюдениями, выполненными на одиночных клонах мезенхимальных стволовых клеток специальной техникой MICRO-SAGE. Микрометод верифицировал присутствие мРНК 1200 ключевых генов эмбриогенеза в одном клоне Мск(Tremain N., Korkko J., Iberson D. еt al., 2001). Полученные данные поражают воображение. В клонах Мск из взрослой гематогенной ткани идентифицированы практически все наборы мРНК зародышевых листков, органогенеза, а также мРНК master-genes, контролирующих рестрикционное созревание линий мезенхимального, мезодермального происхождения, экто- и эндодермы. Клоны Мск по сути представляли собой библиотеки мРНК ранних этапов органогенеза и рестрикционного созревания специализированных линий. Если программы органогенеза обеспечивали направленный импорт мРНК в ядро для включения новых котранскриптаз, транскриптаз и транскрипционных комплексов, то рестрикционное созревание клеточных линий связано с экспортом мРНК из ядра в цитоплазму с последующей модификацией белкового фенотипа прогениторных клеток. В каждом клоне перераспределение мРНК между ядром и цитоплазмой составляет ключевую часть перестройки soft-сети. Репрограммирование генома плюрипотентных клеток наиболее эффективно изучают средствами протеомики. Тотальная реорганизация белковых сетей Эстволовые клетки, составляющих платформу hard-|software, по-видимому, содержит ключи к разгадке эпигенетических процессов у истоков развития (Guo X., Ying W., Wan J. еt al.,2001)
Мультипотентность Мстволовые клетки, выделенных из стромы гематогенной ткани взрослого человека, была верифицирована с помощью их трансплантации в пред- и постимплантационные зародыши овцы (Liechy K.W., MacKenzie T.C., Shaaban A.F. et al., 2000). Ростки трансплантированных Мск человека выявлялись как в плодах, новорожденных, так и в тканях животных через 1-1,5 лет после рождения. Мск человека преимущественно химеризовали хрящевую, жировую ткань, стволовые клеткиелетные мышцы, сердце, строму гематогенной ткани и вилочковой железы. Часть донорских Мск накапливалась в виде перицитов в адвентиции аретриол и мелких венул (Flake A.W., 2001). По-видимому, сосудистая циркуляция играет незаменимую роль в миграции и диссеминации Мск в зародыше. Циркулирующие в крови Мск выявлялись в зародышах человека до 15 нед развития (Compagnoli C., Fisk N., Tocci A. et al, 1999). Мск человека активно химеризовали зародыш овцы, если донорские клетки вводили в амниотическую полость. Мск человека легко преодолевали гематоэнцефалический барьер и детектировались в в разных отделах мозга.
Особый интерес пересадки Мск привлекают в связи с проблемой иммунотолератности реципиентов - химер. Особое внимание уделялась химеризации донорскими Мск стромы тимуса реципиента. Стромальные клетки используют для локального подавления иммунного ответа (на уровне антиген-презентирующих клеток). Наиболее яркий практический пример - это добавление клеток Сертоли в клеточный нейтрансплантат для блокирования иммунного отторжения (Willing A.E., Cameron D., Sanberg P.R., 1998).
Рост клонов Эск в культуре зависит от состава среды, набора факторов пролиферации. Важно,что рост клонов не контролируется факторами мезенхимы, разобщен с работой Нох-генов и генов органогенеза, регулирующих численность клеток в растущем зародыше. Поэтому клоны Эск удается нелимитированнно размножать in vitro, чего не бывает в самом зародыше.
См. также:
 1. На пороге новой биологии и медицины
1. На пороге новой биологии и медицины
 2. Эск: основные определения и концепция
2. Эск: основные определения и концепция
 3. Основные источники и способы выделения Эск (историческая справка)
3. Основные источники и способы выделения Эск (историческая справка)
 5. Особенности фенотипа Эск
5. Особенности фенотипа Эск
 6. Эск - модель для изучения геномики раннего эмбриогенеза и органогенеза
6. Эск - модель для изучения геномики раннего эмбриогенеза и органогенеза
 7. Направленная дифференцировка Эск и ППК in vitro
7. Направленная дифференцировка Эск и ППК in vitro
 8. Эск в изучении функций Нох-генов
8. Эск в изучении функций Нох-генов
 9. Эск - новый биоресурс медицины
9. Эск - новый биоресурс медицины
 10. Эск: законодательство и биоэтика
10. Эск: законодательство и биоэтика
 11. Мост между наукой и клиникой
11. Мост между наукой и клиникой
...
 Обсудить на форуме
Обсудить на форуме


